本品為人血液制品,因原料來自人血,雖然對原料血漿進行了相關病原體的篩查,并在生產工藝中加入了去除和滅活病毒的措施,但理論上仍存在傳播某些已知和未知病原體的潛在風險,臨床使用時應權衡利弊。
>國內首家血液制品GMP認證企業
>國內首家采用雙重病毒滅活工藝用于生產
>國內首家采用全自動采漿機和全自動洗瓶滅菌罐裝生產線的生產企業
>血漿優質安全,多道ELISA(酶聯免疫法)和核酸擴增技術檢測
>不含防腐劑和抗生素,純度高,穩定性好
>全面與世界接軌的標準化體系認證

請仔細閱讀說明書并在醫師指導下使用
本品為人血液制品,因原料來自人血,雖然對原料血漿進行了相關病原體的篩查,并在生產工藝中加入了去除和滅活病毒的措施,但理論上仍存在傳播某些已知和未知病原體的潛在風險,臨床使用時應權衡利弊。
[藥品名稱]
通用名稱:靜注人免疫球蛋白(pH4)
英文名稱:Human Immunoglobulin (pH4) for Intravenous Injection
漢語拼音:Jingzhu Ren Mianyiqiudanbai(pH4)
[成份]
本品活性成份為人免疫球蛋白,主要是IgG,輔料為聚山梨酯80、麥芽糖、注射用水。
[性狀]
本品應為無色或淡黃色澄明液體,可帶輕微乳光,不應出現渾濁。
[適應癥]
1.原發性免疫球蛋白缺乏癥,如X聯鎖低免疫球蛋白血癥,常見變異性免疫缺陷病,免疫球蛋白G亞型缺陷病等。
2.繼發性免疫球蛋白缺陷病,如重癥感染,新生兒敗血癥等。
3.自身免疫性疾病,如原發免疫性血小板減少癥,川崎病。
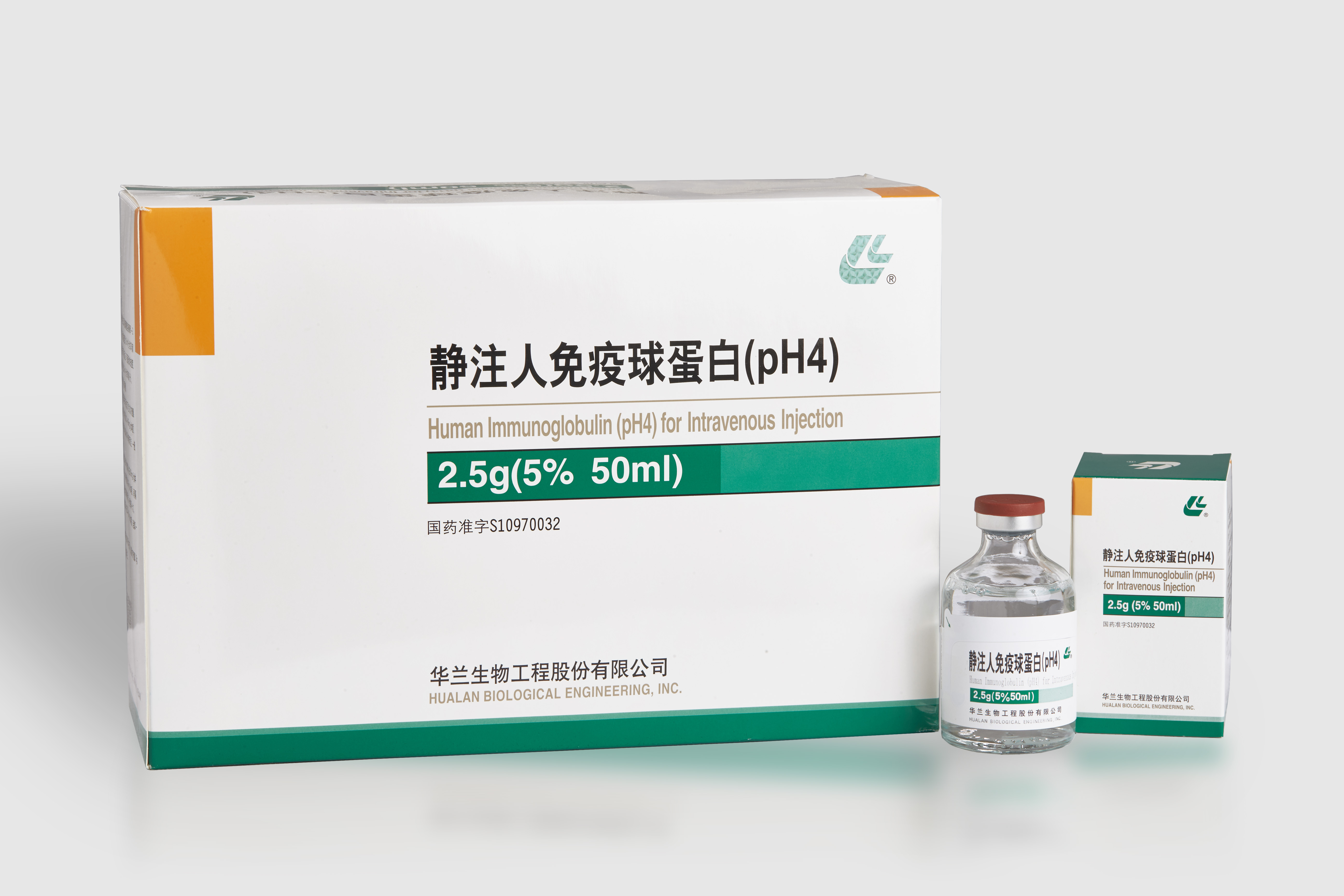
[規格]
2.5g/瓶(5%,50ml)
[用法用量]
用法:靜脈滴注或以5%葡萄糖溶液稀釋1~2倍作靜脈滴注,開始滴注速度為1.0ml/分鐘(約20滴/分鐘)持續15分鐘后若無不良反應,可逐漸加快速度,最快滴注速度不得超過3.0ml/分鐘(約60滴/1分鐘)。
用量:遵醫囑。
推薦劑量:
1.原發性免疫球蛋白缺乏或低下癥:首次劑量:400mg/kg體重;維持劑量:200~400mg/kg體重,給藥間隔時間視病人血清IgG水平和病情而定,一般每月一次。
2.原發免疫性血小板減少癥:每日400mg/kg體重,連續5日。維持劑量每次400mg/kg體重,間隔時間視血小板計數和病情面定,一般每周一次。
3.重癥感染:每日200~300mg/kg體重,連續2~3日。
4.川崎病:發病10日內應用,兒童治療劑量2.0g/kg體重,一次輸注。
[不良反應]
輸注時可能出現一過性頭痛、心慌、惡心等不良反應,可能與輸注速度過快或個體差異有關。上述反應大多發生在輸注開始一小時內,因此建議在輸注的全過程定期觀察患者的一般情況和生命體征,必要時應減慢或暫停輸注,一般無需特殊處理即可自行恢復。 個別患者可在輸注結束后發生上述反應,一般在24小時內均可自行恢復。
1.國外臨床試驗
同類的國外上市產品在超過5%的臨床試驗受試者中觀察到以下常見不良反應:頭痛、寒戰、發熱、疼痛、乏力、背痛、思心、嘔吐、腹痛、腹瀉、輸液部位反應、皮疹、瘙癢、蕁麻疹、高血壓、低血壓、心動過速等。
2.國內上市后監測
本品及同類的國內上市產品監測到如下不良反應事件,由于這些不良反應/事件是在無法確定總數的人群中自發報告的,因此不能準確估算其發生率:
(1)全身性損害:畏寒,高熱、胸痛、不適、蒼白、乏力、眶周水腫、水腫、全身酸痛等。
(2)皮膚及其附件損害:斑丘疹、紅斑性皮疹、局限性皮膚反應、表皮松解、多發性紅斑、皮炎(如大皰性皮炎)、出汗增加等。
(8)免疫功能紊亂和感染:過敏反應、過敏樣反應、輸液反應、過敏性休克等。
(4)心血管系統損害:紫紺、心悸、高血壓、心律失常等。
(5)神經系統損害:頭暈、昏迷、意識喪失、震顫、肌肉不自主收縮、感覺減退等。
(6)呼吸系統損害:呼吸困難、呼吸急促、呼吸暫停、喘息、喉頭水腫、呼吸功能不全、輸血相關急性肺損傷、低氧血癥等。
(7)血管損害和出凝血障礙:潮紅、靜脈炎等。
(8)精神障礙:激越、精神障礙、嗜睡等。
(9)代謝和營養障礙:高血糖。(注:藥品成份中含糖類的,注明此項)
( 10)血液系統損害:白細胞減少、中性粒細胞減少、粒細胞缺乏等。
3.國外上市后監測
同類的國外上市產品還監測到如下不良反應事件,由于這些不良反應事件是在無法確定總數的人群中自發報告的,因此不能準確估算其發生率:
(1)皮膚及其附件損害:史蒂文斯-約翰遜綜合征等。
(2)神經系統損害:癲癇發作、無菌性腦膜炎等。
(3)呼吸系統損害:急性呼吸窘迫綜合征、肺水腫、支氣管痙攣等。
(4)血管損害和出凝血障礙:血栓形成等。
(5)血液系統損害:血漿黏度增加、溶血反應等。
(6)泌尿系統損害:腎功能損害等。
[禁忌]
1.對人免疫球蛋白過敏或有其他嚴重過敏史者。
2.有抗IgA抗體的選擇性IgA缺乏者。
[注意事項]
1.本品專供靜脈輸注用。
2.如需要,可以用5%葡萄糖溶液稀釋本品,但糖尿病患者應慎用。
3.藥液呈現混濁、沉淀、異物或瓶子有裂紋、過期失效等情況下,不得使用。
4.本品開啟后,應一次輸注完畢,不得分次或給第二人輸用。
5.有嚴重酸堿代謝紊亂的患者應慎用。
6.監測急性腎功能衰竭患者的腎功能,包括血尿素氮、血肌酐和尿量。對于腎功能不全或衰竭的患者,要以最小的速度輸注。易感患者使用本品可能引起腎功能異常。
7.可能發生血栓性事件。監測有血栓形成事件已知危險因素的患者;對有高粘血癥風險患者的血液粘度進行基線評估。對于有血栓形成風險的患者,要在最小劑量下緩慢輸注。
8.可能發生無菌性腦膜炎綜合征,特別是在高劑量或快速輸注時。
9.可能發生溶血性貧血。監測溶血和溶血性貧血患者的臨床體征和癥狀。
[孕婦及哺乳期婦女用藥]
未專門進行該項針對性試驗研究,且無系統可靠的參考文獻。對孕婦或可能懷孕婦女的用藥應慎重,如有必要應用時,應在醫師指導和嚴密觀察下使用。
[兒童用藥]
未專門進行該項針對性試驗研究,且無系統可靠的參考文獻。
[老年用藥]
未進行該項試驗研究,且無系統可靠的參考文獻。在65歲以上的患者中,一般情況下,不超過推薦劑量,緩慢輸注。
[藥物相互作用]
本品尚無與其它藥物相互作用的臨床研究資料。因此本品須嚴格單獨輸注,不得與其他任何藥物混合使用。
為了避免被動接受本品中特異性抗體的干擾,輸注本品3個月后才能接種某些減毒活疫苗,如脊髓灰質炎、麻疹、風疹、腮腺炎以及水痘病毒疫苗等。基于同樣的考慮,在非緊急狀態下,已經接種了這類疫苗的患者至少在接種后3~4周才能輸注本品;如果在接種后3~4周內使用了本品,則應在最后一次輸注本品后3個月重新接種。
[藥物過量]
未專門進行該項針對性試驗研究,且無系統可靠的參考文獻。過量使用可能導致患者循環血容量超載和血液粘度增高而增加心臟的負荷,此結果更常見于老年患者和腎功能損傷患者。
[藥理毒理]
本品含有廣譜病毒、細菌或其他病原體的IgG抗體,經靜脈輸注后,能迅速提高受者血液中的IgG水平,增強機體的抗感染能力和發揮免疫調節功能。
[藥代動力學]
未專門進行該項針對性試驗研究。文獻報道,人免疫球蛋白生物半衰期約為3~4周。
[貯藏]
于2~8°C避光保存和運輸。
[包裝]
硼硅玻璃模制注射劑瓶、澳化丁基橡膠塞包裝。1瓶/盒。
[有效期]
自生產之日起36個月。
[執行標準]
YBS10392020
[批準文號]
國藥準字S10970032
[上市許可持有人]
名稱:華蘭生物工程股份有限公司
注冊地址:河南省新鄉市華蘭大道甲1號
[生產企業]
企業名稱:華蘭生物工程股份有限公司
生產地址:河南省新鄉市華蘭大道甲1號
郵政編碼:4530030
電話號碼:(0373) 3519992
傳真號碼:(0373) 3519991
網址: http://www.7501cn.com